Hvordan foregår sigaloverføringene i hjernen?
Ellgren tok for seg hvordan signaloverføringene foregår i hjernens over 700 milliarder hjerneceller ved hjelp av små utløpere, axoner fra hver celle.
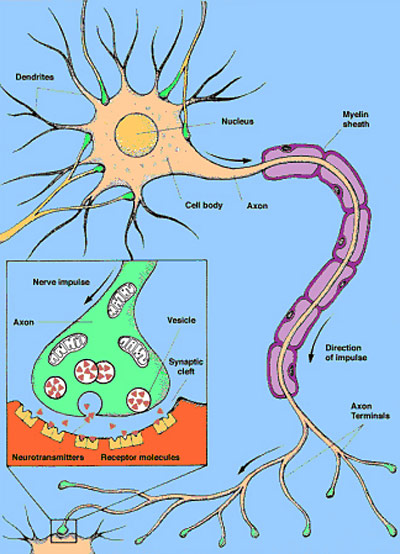
Figur 1: Hjernecelle med utløper og mottakere for signalsubstanser
Figur 1 viser en nervecelle som består av en kjerne og en lang utløper. I enden av utløperen finnes det en synapse, som figuren også inneholder et innfelt, forstørret bilde av. Når et signal kommer og tas imot oppe ved cellekroppen, videresendes det gjennom utløperen som sender signalet videre gjennom å utskille signalsubstanser fra små blærer (vesikler) i nerveenden (synapsen). Når signalet kommer, slipper cellens vesikler ut små mengder av signalsubstanser, som så i neste omgang kan bindes til små mottakere (reseptorer) på neste nervecelle som skal motta signalet. På hver celle finnes det spesifikke sigalsubstanser som binder seg til spesifikke reseptorer. På den måten kan man få ulike effekter av et signal, avhengig av hvilken signalsubstans som slippes ut og hvilken reseptor den binder seg til på neste celle. Eksempel på signalsubstanser som vi har i hjernen er
Glutamat
som er en generell stimulator, en gasspedal
GABA (gamma-aminobutyric acid)
som har en generell bremseeffekt
Dopamin
som påvirker bevegelser og belønning (sentralt i belønningssystemet)
Noradrenalin
som gir respons på stress og fluktbehov
Serotonin
som regulerer følelser, som aggressivitet og depresjon
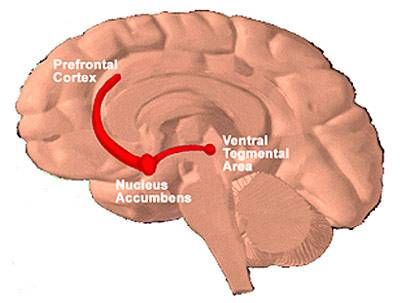
Figur 2: Hjernen med det mesokortikolimbiske
systemet inntegnet
Det mesokortikolimbiske dopaminsystemet
- hjernens belønningssystemHjernens belønningssystem - det mesokortikolimbiske dopaminsystemet (se også artikkelen Hva er avhengighet i et nevrobiologisk perspektiv? Red.) består av nerveceller som har sin cellekropp i det Ventraltegmentale området (VTA) i hjernestammen, og har dopaminholdige utløpere til Nucleus Accumbens der de slipper ut dopamin dersom de blir aktivisert. Man har sett at alle avhengighetsskapende rusgifter aktiviserer belønningssystemet. Det de har felles, er at de øker dopamininnholdet i Nucleus Accumbens.
Økt dopamin-aktivitet i nucleus accumbens etter inntak av cannabis
I figur 3 ser vi gjengitt resultatene av et eksperiment hvor man har målt dopamin i Nucleus Accumbens hos rotter etter inntak av henholdsvis koksalt og cannabis.. Den svarte linjen viser hvordan dopamininnholdet forandrer seg når dyret får en injeksjon koksalt. Som man ser, skjer det da ingen ting, dopamininnholdet fortsetter å være som det var i utgangspunktet. Men når dyret istedet fikk en injeksjon med cannabis, steg dopamininnholdet med 50 prosent, sammenlignet med utgangspunktet. Dette kan man korrelere til en belønningseffekt. Denne belønningseffekten er felles for alle rusgifter, men også de naturlige stimuliene, som matinntak, sex, fysisk aktivitet osv. gir en dopaminøkning.
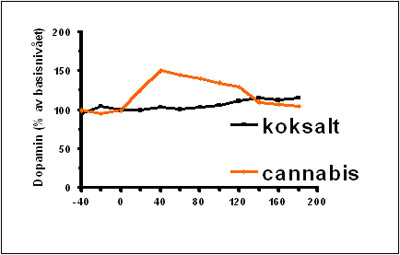
Figur 3: Sammenlignende effekt på dopamininnhold i nucleus accumbens hos rotte etter inntak av koksalt og cannabis.
Når det gjelder begrepet cannabis i denne sammenheng, så betyr det
D-9-tetrahydrocannabinol (THC), det mest psykoaktive stoffet i cannabisplanten. Men hjernen er også utstyrt med sine kroppsegne (endogene) cannabinoider. Vi har altså allerede cannabis i hjernen, noe man ble klar over i løpet av 90-tallet. De to viktigste er Anandamid og
2-arachidonyl glycerol (2-ag). Det er ennå ikke helt klart hvilke effekter disse har, men de spiller en rolle i reguleringen av ulike signaler, har man kommet fram til. De er bl.a. innblandet i hukommelsesfunksjonen og påvirker appetitten.
Da man oppdaget at mennesker har cannabinoider i hjernen, oppdaget man også at hjernecellene har egne mottakerstasjoner som cannabinoidene kan binde seg til og derigjennom ha en effekt. Det finnes to ulike typer reseptorer. Den ene heter CB1, og det er den som finnes i hjernen i et stort antall. Den andre heter CB2 og finnes ute i resten av kroppen, framfor alt i immunsystemet. Disse to reseptorene er inhibitoriske (dempende). Når cannabis binder seg til CB1-reseptoren, dempes aktiviteten i nervecellen.
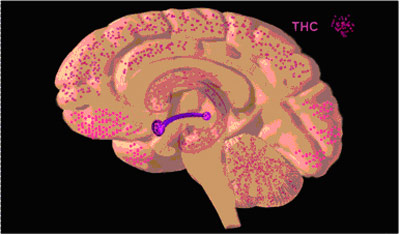
Figur 4: Forekomsten av cannabisreseptorer i hjernen
I Figur 4 viser de rosalilla prikkene hvor i hjernen cannabisreseptorene er mest utbredt, men som man ser er de sterkt spredd ut over hele hjernen.
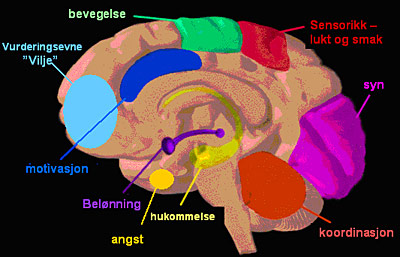
Figur 5: Hjernefunksjoner
Man ser av figur 4 og 5 at det er svært mange cannabisreseptorer i frontal cortex der vurderingsevne og vilje har sin basis. Man ser også at det er cannabisreseptorer i hjernebarken i det hele tatt, og når man ser hvilke funksjoner som finnes der, så kjenner man igjen mange av effektene av cannabis. stoffet påvirker vurderingsevne og vilje, bevegelsesmønsteret blir annerledes, finmotorikken endrer seg, sensorikken endrer seg, man får andre typer sanseopplevelser, synsevnen og koordinasjonen i lillehjernen påvirkes. Hukommelsen påvirkes svært mye. Man kan få angstanfall. Motivasjon og innlæring svekkes når belønningssystemet påvirkes.
Cannabis og belønningssystemet
Dersom man gjør et dypdykk i belønningssystemet, kan man illustrere en nervecelle som går fra VTA til Nucleus accumbens (figur 6).
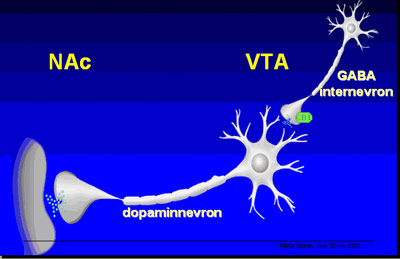
Figur 6: Skisse av nervecelle i VTA med utløp til nucleus accumbens.
Man ser av figur 6 en skisse av en nervecelle i VTA med en dopaminnevron eller utløper som går til nucleus accumbens. I VTA finnes det også GABA-internevroner, små nevroner som sender signaler innenfor VTA-området. Og på de nervecellene sitter det cannabis-reseptorer, markert med grønt i figur 6. Når så cannabis kommer inn i kroppen, og binder seg til CB1-reseptoren, får denne nervecellen en dempet effekt. Dersom cannabis binder seg til CB1-reseptoren, slipper cellen ut mindre GABA, og GABA var, som vi husker, den signalsubstansen som har en bremsende effekt på hjernen. I VTA finnes det altså nerveceller som slipper ut bremseeffekt (GABA) hele tiden. Når cannabis kommer inn og binder seg til mottakerstasjonene på disse cellene, så dempes deres aktivitet, da slipper de ut mindre GABA, og de dopaminnevronene som var bremset i sin aktivitet av GABA, de blir nå friere i sin aktivitet og kan begynne å signalisere mer ved å slippe ut mer dopamin, og det resulterer i en dopaminøkning i nucleus accumbens- som altså var senteret for belønning og innlæring.
Men det er ikke bare dopamin som er viktig i belønningssystemet. Særskilt når det gjelder cannabis så er også kroppens egne opioider, endorfinene viktige. De har i seg selv en funksjon når det gjelder å framkalle eufori (velværefølelse, rus), og også glutamat er innblandet i belønningsopplevelsen. Framfor alt har man sett at glutamat har en viktig funksjon i forbindelse med rusgiftsuget, noe som er svært sentralt i selve avhengighetsproblemet. GABA og serotonin er også innblandet. Men når det gjelder cannabis så er det først og fremst de kroppsegne (endogene) endorfinene som spiller en svært stor rolle. Man har sett at når man inntar cannabis, frigjøres det opidoider i belønningssystemet., og man får en euforisk følelse, en rus.
Cannabis som gateway drug
Cannabisbruk er vanligst blant ungdom. En undersøkelse viste at 21 prosent av europeiske ungdommer i videregående skolealder har prøvd cannabis. I Norge og Sverige er disse tallene heldigvis litt lavere, henholdsvis 9 og 7 prosent. Det er ekstra urovekkende at cannabis er utbredt nettopp i tenåringsalderen, fordi i løpet av denne tiden skjer det en stor utviklingsprosess i hjernen, det oppstår nye signalbaner, mens gamle faller bort, og det er svært mye som skjer. Dersom det er så mye som skal finjusteres fram og tilbake, og man tilsetter noe utenfra, er det uheldig fordi man i det tidsrommet er ekstra sårbar. Det man har sett hos ungdom som bruker cannabis i tenåringsalderen, er en økt risiko for kognitive forstyrrelser, man har sett en kobling til utvikling av schizofreni og også at et sykdomsforløp kan forverres på grunn av cannabis. Alt som gjelder cannabis virkninger blir ofte gjenstand for diskusjon, men for kort tid siden kom det en bunke nye studier som dokumenterte at cannabis virkelig var årsaken til en forhøyet risiko, og at det ikke bare tilfeldigvis var personer som hadde hatt psykiske vanskeligheter tidligere som brukte cannabis som selvmedisinering, eller lignende forklaringer. Det er cannabis i seg selv som forårsaker at sykdommen bryter ut. Men selvsagt kan mange ha en bakenforliggende sårbarhet i utgangspunktet. Sist men ikke minst har man også sett en økt risiko for avhengighetsutvikling av andre rusgifter i forlengelsen av cannabisbruk. Risikoen for å pådra seg andre rusgiftproblemer senere øker dersom man bruker cannabis.
Oppsummeringsvis kan man si at cannabisbruk fører til:
- Økt risiko for kognitive forstyrrelser (Eherenreich et al 1999, Pope et al 2003)
- Økt risiko for utvikling av schizofreni samt dårligere sykdomsforløp (Arseneault et al 2002, Fergusson et al 2003, van Os et al 2002, Green et al 2004, Veen et al 2004)
- Økt risiko for avhengighetsutvikling av andre rusgifter(Yamaguchi and Kandel 1984, Fergusson and Horwood 2000, Lynskey et al 2003, Agrawal et al 2004)
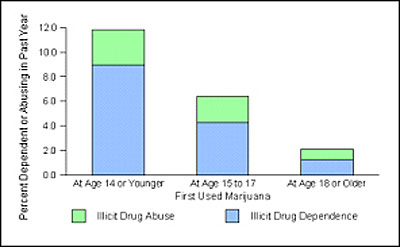
Figur 7: Prosentandel som foregående år var stoffavhengige blant voksne som begynte å røyke marihuana på ulike alderstrinn. (NHSDA 2001)
Figur 7 viser tall fra en amerikansk helseundersøkelse som kartla hvor stor prosentandel blant voksne som siste år hadde rusgiftproblemer, og som fortsatt var avhengige av ett eller annet stoff, etter hvor tidlig de hadde begynt å røyke marihuana. Man så på dette i forhold til om de hadde begynt før/mens de var fjorten år, om de hadde begynt i 15-17 årsalderen, eller om de hadde begynt når de var 18 år eller eldre. Av disse tallene kan vi se at de som begynte tidligst, hadde den høyeste risikoen for fortsatt å være i en avhengighetssituasjon i voksen alder. Men en innvending som kan gjøres er jo at det kan være andre bakenforliggende årsaker til at man begynner å røyke marihuana tidlig, slik at observerte sammenhenger mellom tidlig marihuanabruk og senere rusgiftavhengighet kunne bero på årsaker, som genetisk sårbarhet, tilgang på stoff og risikotakende atferd og dårlig impulskontroll. Noen studier har kontrollert for andre bakenforliggende faktorer, som sosial status og mener å kunne dokumentere en årsakssammenheng mellom tidlig cannabisdebut og økt risiko for senere avhengighetsproblemer.
Cannabisforskning ved Karolinska Institutet
Ved Karolinska Institutet har man også stilt seg spørsmålet om de klare sammenhengene også kunne bero på at cannabiseksponering påvirker nevrobiologien i belønningssystemet og således øker sårbarheten for andre rusgifter, at det skjer en sensitisering som øker motivasjonen for å ta en rusgift. Dette gjelder, som vi vet, i hvert fall overfor den samme rusgiften som man brukte fra begynnelsen. Men kan det tenkes at det også skjer en sensitisering på tvers av de ulike rusgifttypene, at man begynner med cannabis, og deretter begynner på trappetrinn 3 når det gjelder neste stoff? Ellgren og hennes team besluttet å bruke en dyremodell for å se på dette, for å fjerne innflytelsen fra alle slags sosiale faktorer og andre forstyrrende bakenforliggende komponenter som gjør det vanskelig å tolke resultatene av humanstudier. På den måten ville de bli i stand til å se bare på biologien i hjernen, på hvordan cannabis påvirker hjernens belønningssystem. De ga rotter cannabis på det alderstrinn som tilsvarer tenårsperioden hos mennesker, da de var et par uker gamle, for å se hvor sårbare de var for en heroinavhengighet. Man valgte heroin, fordi cannabis og opiater har mange fellestrekk. Opiater aktiviserer opiatreseptorer i hjernen (My, Delta og Kappa) som er inhibitoriske reseptorer som minsker nervecellens aktivitet, og gir en følelse av eufori, rus (My og Delta) eller dysfori, ulystfølelse (Kappa). På samme måte som cannabis frigjør endorfiner, så skjer det samme også med opiatene. Disse endorfinene (enkefalin, beta-endorfin, dynorfin) har en viktig funksjon i reguleringen av stemningsleiet, og man kan se endringer i endorfinnivået i hjernen bl.a. ved depresjon og rusgiftavhengighet. I dyrestudier har man sett sterke koblinger mellom de to signalsystemene for henholdsvis opiater og cannabis.
For eksempel dersom man studerer mus som man har avlet fram på en slik måte at de mangler cannabisreseptorer, og lar disse få fri tilgang til morfin, så vil de ikke ha det, mens normale mus raskt utvikler en opioidavhengighet. Derimot vil musene uten cannabisreseptorer fortsatt ha nikotin og kokain. Man har også sett at både rotter og aper som har utviklet en avhengighet av heroin i en selvadministreringsmodell, og som får blokkert sine cannabisreseptorer, ikke lenger vil ha heroin. På samme vis finner en at cannabisavhengige dyr som får blokkert sine opiatreseptorer, ikke lenger vil ha cannabis. Man blokkerer reseptorer ved å tilføre antagonister, dvs. stoffer som binder seg til henholdsvis opiat- og cannabisreseptorene, slik at opiater og cannabis ikke lenger slipper til og kan utøve noen virkning. (Antagonister for opiater er kjent, bl.a. naltrexon, mens tilsvarende for blokkering av cannabisreseptorer ikke er så kjent. Det finnes imidlertid et stoff, Acomplia (rimonabant), som har tilsvarende virkning på cannabisreseptorene, og som for mennesker foreløpig er tatt i bruk i en del land som et fedmereduserende legemiddel cannabis påvirker som vi så appetitten. Red.).
Man så altså på hva som skjedde i hjernen når man ga rotter cannabis i løpet av tenåringsperioden, for å se om de lettere falt inn i en heroinavhengighet. Man ga dyrene en relativt liten dose cannabis i løpet av tre uker i pubertetsalderen, en injeksjon hver tredje dag, slik at bruken skulle være sporadisk, slik den er i starten for mange tenåringer. En gruppe kontrolldyr fikk koksaltoppløsning istedenfor cannabis. En uke senere tok man ut hjernene på noen av dyrene og brukte dem til molekylære studier, for å se hva som hadde skjedd i belønningssystemet. Resten fikk deretter tilgang til heroin. Figur 8 viser en av rottene som fikk adgang til å tilføre seg selv heroin.

Figur 8: Rotte med påkoblet utstyr for selvadministrering av heroin.
Tre timer daglig fikk rottene tilbringe i dette buret (figur 8), hvor det var to pedaler som rottene kunne trykke på. Dersom de trykte på den ene pedalen, fikk de en injeksjon av heroin. Trykte de på den andre, hendte ingen ting. Dette er en svært viktig modell i rusgiftavhengighetsforskning. Dyrene får jo velge selv om de vil ta stoffet eller ikke. Med en slik modell har man sett at alle rusgifter som skaper avhengighet hos mennesker, også gjør det samme hos dyr. Dette gjelder også cannabis. Det har vært hevdet i legaliseringsdebatten at cannabis ikke er avhengighetsskapende fordi stoffet ikke selvadministreres av dyr. Dette stemmer ikke. I noen eldre studier hadde man ikke lykkes i å løse problemene rundt selvadministrasjonsteknikkene for cannabis godt nok, men Ellgren hevdet at det nå er allminnelig erkjent at også cannabis skaper avhengighet ved selvadministrasjon hos forsøksdyr. Det man så i studien ved Karolinska Institutet var at rotter som hadde fått cannabis i tenåringsperioden, også tok mer heroin, sammenlignet med forsøksdyr som bare hadde fått koksaltoppløsning istedenfor cannabis i løpet av pubertetsperioden.
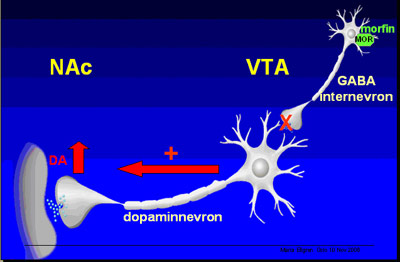
Når man tok ut hjernene og så på hva som hadde skjedd i belønningssystemet, kunne man se at i nucleus accumbens hadde de et økt uttrykk av enkefalin rMNA, dvs. en økt endorfinsignalisering. Også i VTA, der dopamincellekroppene har sitt sentrum, kunne man se at de hadde en økt funksjon i My-reseptoren, den opiatreseptoren som som gir eufori.
Figur 9: Heroin og belønningssystemet
Som vi ser av figur 9, sitter det på samme sted på de små internevronene i VTA også My-reseptorer, som opiater binder seg til. Og på samme måte som cannabis virket på CB1-reseptoren, virker også opiater gjennom My-reseptoren, og opphever dennes bremseeffekt, slik at dopaminnevronene slippes fri, og det skjer en dopaminøkning i nucleus accumbens. De rottene som hadde fått cannabis i løpet av tenårsperioden hadde langt flere My-reseptorer i VTA. Den bremseopphevende virkningen som inntreffer når opiater binder seg til My-reseptorene blir altså større for de cannabiserfarne rottene. Når det finnes flere My-reseptorer, blir sluttresultatet mer dopamin i nucleus accumbens. Det tyder på en økt heroineffekt som følge av tidlig eksponering for cannabis.
Oppsummering av effekten av cannabiseksponering under tenårsperioden

- Humanstudier har vist en økt risiko for kognitive svekkelser, shcizofreni og annen rusgiftavhengighet (gateway-effekt)
- Rotteforsøk har vist at økt heroininntak og opioidrelaterte forandringer i belønningssystemet hos voksne rotter støtter gateway-hypotesen.
(Ellgren et al 2006 Neuropsychopharmacology, Epub July 5)
Oppsummmering av cannabis avhengighetsskapende potensiale generelt
- I hjernen finnes det spesifikke cannabisreseptorer og kroppsegne cannabinoider (anandamid og 2-AG)
- Cannabis, som alle avhengighetsskapende rusgifter, øker dopaminaktiviteten i belønningssystemet, og gir dermed opphav til en rus.
- Cannabis selvadministreres av forsøksdyr.

